La production de méthane à partir de dioxyde de carbone soulève des interrogations sur l’efficacité énergétique et la durabilité environnementale. Des chercheurs ont récemment élaboré une technique novatrice utilisant l’électricité verte pour synthétiser ce composé de manière écologique. Cette approche remet en question les méthodes traditionnelles de transformation des gaz à effet de serre en ressources utiles, ouvrant de nouvelles pistes pour l’industrie chimique et énergétique.
Un catalyseur pour la synthèse du méthane
Une équipe de scientifiques de l’Université de Bonn et de l’Université de Montréal a conçu un catalyseur innovant permettant la production de méthane à partir de dioxyde de carbone et d’eau avec une efficacité remarquable, en utilisant l’électricité.
Le méthane, composant principal du gaz naturel, trouve de nombreuses applications dans le chauffage résidentiel et l’industrie chimique. Sa production à partir d’électricité verte lui confère une neutralité climatique quasi-totale. Les connaissances acquises grâce à ce système modèle pourraient être appliquées à des catalyseurs techniques à grande échelle.
L’électricité comme moteur de la réaction
Nikolay Kornienko, chercheur à l’Institut de chimie inorganique de l’Université de Bonn, a expliqué : «L’électricité a été utilisée comme force motrice dans notre processus. En employant de l’électricité respectueuse du climat, nous pouvons produire du méthane qui ne contribue pas au réchauffement climatique.»
La synthèse du méthane (CH4) présente des défis techniques car elle nécessite une réaction entre un gaz (CO2) et un liquide (H2O). L’équipe de recherche a utilisé une électrode à diffusion gazeuse pour faciliter l’interaction entre ces deux composés. La réaction implique la séparation des deux atomes d’oxygène du carbone et leur substitution par quatre atomes d’hydrogène provenant de l’eau.
«L’eau aurait tendance à subir une autre réaction et se décomposerait en hydrogène et oxygène dès son exposition à un courant électrique. Cette réaction concurrente doit être évitée pour permettre la production de méthane. Par conséquent, l’eau doit être maintenue à distance de l’électrode tout en restant disponible comme réactif.» a souligné Morgan McKee, l’assistant de Nikolay Kornienko ayant réalisé une grande partie des expériences.
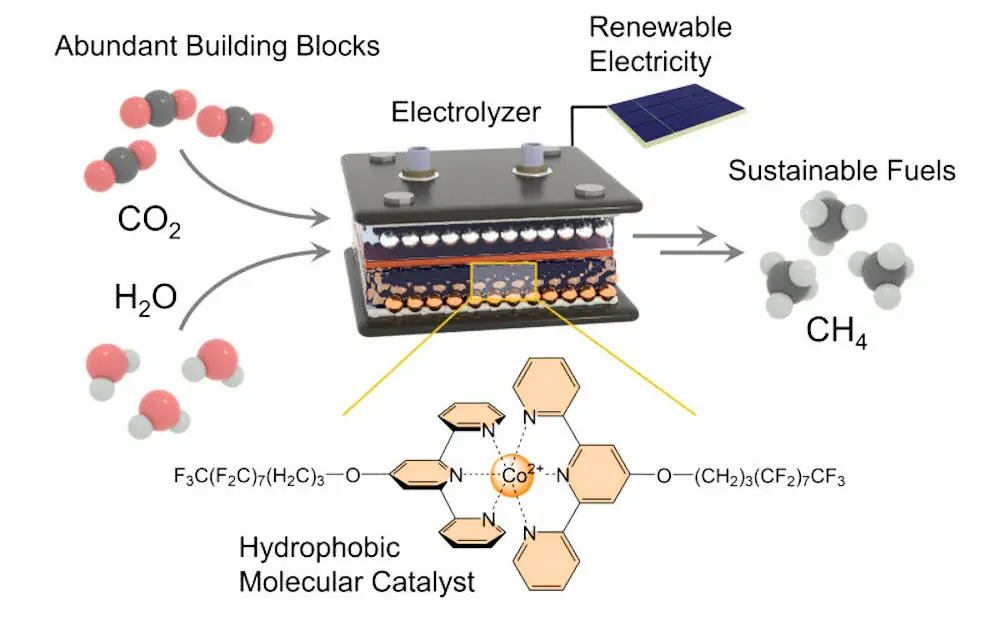
Le nouveau catalyseur déposé sur l’électrode joue un rôle essentiel. Il favorise principalement la réaction du dioxyde de carbone pour produire du méthane plus rapidement et efficacement. Son «centre actif» retient le dioxyde de carbone et affaiblit les liaisons entre l’atome de carbone et les deux atomes d’oxygène.
Des chaînes moléculaires hydrophobes au cœur du processus
Pour prévenir les réactions secondaires indésirables, les chercheurs ont greffé de longues chaînes moléculaires latérales au centre actif. Le Pr Kornienko a précisé : «La structure chimique de ces chaînes repousse l’eau, les rendant hydrophobes.»
Ces chaînes latérales remplissent une double fonction : elles éloignent les molécules H2O du centre actif et de l’électrode, tout en agissant comme un système de transport. Elles capturent les atomes d’hydrogène des molécules d’eau et les acheminent vers le centre actif, où ils réagissent avec l’atome de carbone. Ainsi, le CO2 est transformé en CH4 par étapes successives.
Ce processus affiche une efficacité supérieure à 80% et génère très peu de sous-produits indésirables. Bien que ce catalyseur ne soit pas adapté à la production de méthane à grande échelle, les principes de réaction découverts pourraient être appliqués à d’autres matériaux catalytiques pour des applications industrielles.
Selon le Pr Kornienko, la production de méthane n’est pas l’unique domaine d’application de cette méthode. Elle pourrait s’avérer plus avantageuse dans la synthèse d’autres composés chimiques tels que l’éthylène, utilisé comme matière première dans l’industrie plastique. À moyen terme, cette nouvelle approche catalytique pourrait contribuer à rendre la production de plastique plus respectueuse de l’environnement.
Article: « Hydrophobic molecular assembly at the gas-liquid-solid interface drives highly selective CO2 electromethanation »; Nature Chemistry; DOI: 10.1038/s41557-024-01650-6